OGM ET FABRICATION DE VACCINS
 Michel Georget, Agrégé de Biologie Etudes supérieures à la Faculté des Sciences de Poitiers . Professeur honoraire de biologie des Classes Préparatoires aux Grandes Ecoles. Auteur du livre « VACCINATIONS, les vérités indésirables » (EditionsDangles), membre du Conseil Scientifique du CRIIGEN.
Michel Georget, Agrégé de Biologie Etudes supérieures à la Faculté des Sciences de Poitiers . Professeur honoraire de biologie des Classes Préparatoires aux Grandes Ecoles. Auteur du livre « VACCINATIONS, les vérités indésirables » (EditionsDangles), membre du Conseil Scientifique du CRIIGEN.
EVOLUTION DE LA FABRICATION DES VACCINS
PREMIERS VACCINS:
- Immunité croisée vaccine-variole
- Souches microbiennes atténuées par vieillissement des cultures ou par passage sur tissus animaux
- Souches microbiennes tuées (inactivées ) par la chaleur ou des agents chimiques (formol) : typhoïde, coqueluche , anatoxines ( diphtérie, tétanos ) ou par culture prolongée ( BCG) .
- Mise au point des cultures cellulaires permettant la culture des virus: polio, rougeole, rubéole , oreillons
- Vaccins issus du génie génétique
VACCINS ISSUS DU GENIE GENETIQUE
- Vaccins à base de produits issus d’OGM ( obtention de protéines antigéniques)
- Vaccins OGM issus de recombinaisons
- Vaccins obtenus par mutagenèse dirigée
VACCINS A BASE DE PROTEINES ISSUES D’OGM
2 groupes de vaccins : Vaccins anti-hépatite B , vaccins anti-papillomavirus ( HPV)
- pourquoi? Parce que le virus de l’hépatite B et les papillomavirus ne sont pas cultivables in vitro, leur patrimoine génétique est constitué d’ADN, les protéines contenues dans ces vaccins sont obtenues à partir de levures ou de cellules de lignée continue ( CHO ou Trichoplusia ni)
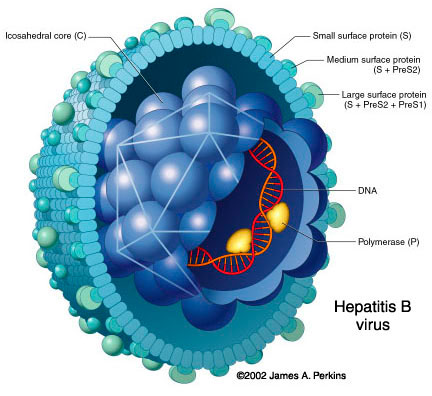
EXEMPLE DE L’HEPATITE B
Pour fabriquer la Protéine S antigénique (protéine d’enveloppe), il faut avoir l’information (le gène) , être capable de la faire pénétrer dans les cellules qui vont traduite cette information, être capable de trier les cellules qui ont bien reçu l’information.
LES OUTILS DU GENIE GENETIQUE
- Les « ciseaux » pour isoler le gène : ce sont des enzymes qui reconnaissent des séquences particulières et coupent l’ADN en des points précis
- Les « pots de colle » : ce sont des enzymes qui soudent les fragments d’ADN
- Les « véhicules de transport » : plasmides bactériens ou virus
Exemple du GenHevac B:
- Obtention du vecteur recombinant
Principe : —————————————-> Cas du GenHevacB
Isoler le gène porteur de l’information —— >Isolement du gène S
L’introduire dans un vecteur ( plasmide )—->Plasmide du colibacille
Ajouter promoteur et gènes régulateurs——>Promoteur et séquences ——————————————————régulatrices du virus SV40
Nécessité d’un gène marqueur—————–>Gène dhfr ( résistance à un produit toxique)
Nouveau promoteur et gènes régulateurs——>Promoteur du virus MMTV + séquences ——————————————————–régulatrices du SV40
Le virus SV40 est un virus de singe ( virus cancérigène) , le virus MMTV est le virus de la Tumeur Mammaire de la souris , virus cancérigène)
Le plasmide recombinant ainsi constitué comprend donc le plasmide d’origine ( au moins en partie) + le gène S que l’on cherche à faire exprimer + le gène de résistance dhfr ( dihydrofolate réductase, résistance au méthotrexate) + promoteur et séquences activatrices du SV40 + le promoteur du MMTV ( Mouse mammary tumor virus)
2.Transfert dans les cellules qui vont exprimer le gène
Principe:——————————————-> Cas du GenHevac B
Transfert du gène choisi dans les cellules —–>Transfert dans les cellules de lignée ——————————————————–continue (CHO )
Tri des cellules————————————->Traitement par le méthotrexate
Expression du gène choisi————————>Synthèse de la protéine HBs
Purification—————————————–>Purification
Le tri des cellules se fait un traitement au méthotrexate, sélection des cellules transfectées ( recombinées) , la cellule survivante est celle qui a reçu le gène S avec le gène marqueur de résistance au méthotrexate ( dhfr) . et est donc la cellule capable de synthétiser la protéine HBs
Les cellules de lignée continue CHO proviennent de l’ovaire de hamster de Chine .
Quelques différences entre les vaccins HB
GenHevac B————-/—–Engerix et HB vax DNa
-Protéine HBs avec séquence pré-S2——/———-Protéine HBs sans séquence pré-S2
-Production par cellules de lignée continue CHO-/-Production par cellules de levure
-HBs glycosylée —————/————-HBs non glycosylée
-Excrétion des protéines par les cellules-/-Protéines non excrétées , broyage indispensable, ce qui complique le processus de purification
CAS DES PAPILLOMAVIRUS
FABRICATION DES VACCINS ANTI HPV
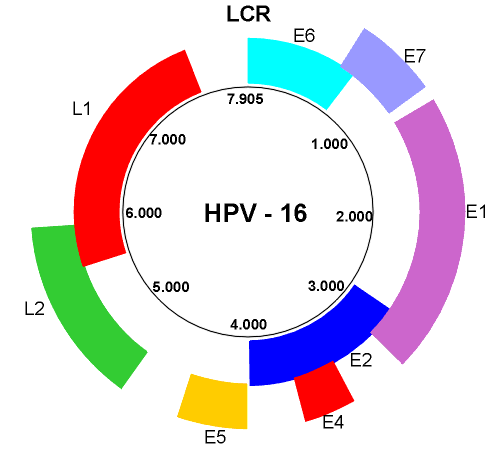
Les vaccins contre les Papillomavirus à partir de la protéine de surface L1 de chaque des papillomavirus choisi pour chaque vaccin. Ces protéines obtenues par génie génétique, ont la propriété de s’auto-assembler en particules vides ressemblant au virus ( Virus Like Particles ou VLP) mais sans information génétique.
Les ETAPES DE LA FABRICATION
- Isoler les gènes responsables de la synthèse des protéines d’enveloppe (L1) de ce virus
- Insertion de ces gènes dans un vecteur
- Recueillir les protéines récoltées fabriquées par les cultures cellulaires et les purifier
- Ces protéines ( sous réserve qu’elles soient produites par des cellules eucaryotes) s’associent en pentamères, lesquels s’assemblent pour constituer des particules vides ressemblant au virus (VLP)
DEUX VACCINS SE PARTAGENT LE MARCHE
LE VACCIN GARDASIL ® (Merck) est un vaccin quadrivalent constitué de 4 types de VLP comportant les protéines L1 des types 6, 11, 16 et 18 obtenues à partir de cultures de levures ( saccharomyces cerevisiae). Il a comme adjuvant l’hydroxyphosphate d’aluminium (AI: 225microg)
Le VACCIN CERVARIX® (GSK) est un vaccin bivalent dirigé contre les HPV 16 et 18 . Les protéines L1 sont obtenues par infection de cellules d’insectes Hi-5 Rix4446 dérivées de Tricoplusia ni ( Lépidoptère ) par un baculovirus ayant intégré le gène correspondant. Il contient un nouvel adjuvant ( AS04) qui renferme 500 μg d’aluminium et 50 μg de lipide monophosphoryl lipid A (MPL)
LES INCERTITUDES DE CES TECHNIQUES DU GENIE GENETIQUE
Ce n’est pas une technique chirurgicale
- Les « ciseaux » ne coupent pas l’ADN exactement au début et à la fin du gène
- Il y a donc des morceaux supplémentaires ou manquants
- La protéine aura donc des acides aminés en plus ou en moins
- La preuve : la masse moléculaire de la protéine S n’est pas la même 29kDa dans le virus, 22kDa dans le vaccin GenHevac B®
===> Conséquence sur le repliement de la molécule qui dépend de la série des acides aminés , ce repliement dépend aussi de l’environnement cellulaire ( Ph, modification des protéines) , conséquence pour la reconnaissance de la protéine par les lymphocytes producteurs d’anticorps
VACCINS OGM ISSUS DE RECOMBINAISONS
ROTAVIRUS, ENCEPHALITE JAPONAISE, DENGUE
VACCINS CONTRE LES ROTAVIRUS
- Les 1ers vaccins, fabriqués à partir de virus animaux (2 virus bovins et un virus simien ( singe ) ont été rapidement abandonnés.
- Puis , sont venus les vaccins à virus recombinants entre souches animales et humaines:
- Virus recombinants humain-simien ( singe Rhésus ), abandonné suite à des cas graves d’invagination intestinale
Virus recombinant humain-bovin : le Rotateq®
Le vaccin Rotateq® ( Merck, Sanofi-Aventis) est un vaccin pentavalent vivant atténué, cultivé sur cellules de lignée continue Véro. Il contient 5 souches de Rotavirus recombinants entre un virus bovin et 4 virus humains obtenus en co-culture. Ces virus sont essentiellement bovins avec une protéine humaine à leur surface. Il contient des résidus du milieu de culture , de SVF et d’ADN ( <100μ/dose)
DES DIFFICULTES à l’horizon
- La stabilité des virus atténués n’est pas établie ( réversion possible)
- 15 à 50% des vaccinés excrètent des virus vivants dans leurs selles ( donc dans l’environnement ). D’où risque de recombinaison entre une souche vaccinale et une souche sauvage en cas d’infection naturelle d’un enfant vacciné.
- Ce vaccin ne doit pas être administré si l’enfant est en contact étroit avec une personne atteinte d’un cancer ou prenant des médicaments pouvant affaiblir le système immunitaire ( EMEA résumé des caractéristiques du produit )
VIRUS DES FIEVRES HEMORRAGIQUES
Flavivirus ( ARN monocaténaire +) : Fièvre jaune, encéphalite japonaise, Dengue
Filovirus (ARN monocaténaire – ) : Ebola, Fièvre de Marburg
Structure des Flavivirus
3 protéines structurales ( C, prM et E). La protéine C est présente dans la capside , la protéine prM est un précurseur de la protéine M qui est retrouvée dans la membrane et la protéine E est la composante principale de l’enveloppe.
Vaccin Imojev®, contre l’encéphalite japonaise
- Obtenu par recombinaison génétique à partir de la souche 17D du virus de la fièvre jaune dans laquelle 2 gènes des protéines d’enveloppe ( prM et E) ont été remplacés par 2 gènes correspondants du virus de l’encéphalite japonaise.
- Ce vaccin Imojev®, actuellement homologué en Australie , en Malaisie, aux Philippines et en Thaïlande, associe donc des éléments de virus qui ne se rencontrent jamais dans la nature, le virus de la fièvre jaune n’affectant pas les pays asiatiques et le virus de l’encéphalite japonaise n’affectant ni les pays africains ni l’Amérique du Sud.
VACCINS CONTRE LA DENGUE (grippe tropicale)
- Virus appartenant à la même famille que celui de la fièvre jaune. 4 souches différentes.
- Chaque souche peut faire développer des anticorps mais il n’y a pas de réaction croisée.
- Après guérison d’une première infection, l’infection par une autre souche peut déclencher une fièvre hémorragique rapidement mortelle.
- Un individu est susceptible d’être infecté par chacun des 4 sérotypes de la dengue au cours de sa vie.
- Un vaccin efficace contre la dengue devra donc être en capacité de conférer une immunité protectrice contre l’ensemble des sérotypes ( sous peine de prendre le risque de déclencher une fièvre hémorragique si infecté par une souche différente de celle présente dans le vaccin)
LE VACCIN CYD ( Chimirec yellow fever dengue )
- 28 avril 2014 : annonce de résultats encourageants d’une première étude de phase III pour un vaccin contre la dengue nommé CYD ( Chimeric yellow fever dengue ). Il s »agit d’un vaccin tétravalent vivant atténué, fabriqué sur le même modèle que le vaccin Imojev®.
- 4 vaccins monovalents , correspondants aux 4 sérotypes du virus, sont produits en remplaçant les gènes prM et E du virus de la fièvre jaune par les gènes correspondants des 4 souches du virusn de la dengue , puis associés pour former le vaccin tétravalent.
LES RISQUES
- La recombinaison entre les virus du vaccin tétravalent et des virus de la dengue ou de la fièvre jaune circulants est théoriquement possible.
- Comme les autres virus à ARN, le génome du virus de la dengue est en constante variation à cause de l’ ARN polymérase qui n’a pas de mécanisme de vérification des erreurs.
- Les moustiques qui véhiculent tous ces virus vont constituer le milieu de culture idéal pour permettre les recombinaisons génétiques et faire émerger de nouveaux virus pathogènes.
Il y a eu des précédents !
En juillet 2012 , en Australie , une recombinaison de 2 souches vaccinales contre la laryngotrachéite infectieuse aviaire avait fait apparaître une souche recombinée plus virulente que la souche sauvage d’origine. Une hécatombe s’en est suivie dans les élevages de volailles.
Essai d’un autre vaccin contre la dengue
Vaccin dérivé de celui de la rougeole dirigé contre les 4 souches du virus
Essai pré-clinique chez l »animal ( 07/2014) . Capable de déclencher à la fois une réponse immunitaire humorale (production d’anticorps ) et une réponse cellulaire
VACCIN CONTRE LES VIRUS EBOLA
Divers essais
- Un vaccin à ADN nu : injection IM de plasmides recombinés contenant des gènes des protéines de surface du virus
- Utilisation d’un vecteur adénoviral contenant ces gènes
- ou les 2 méthodes successivement
VACCINS PAR MUTAGNESE DIRIGEE
Exemple : les composants des nouveaux vaccins acellulaires contre la coqueluche
- Toxine pertussique
- Hémagglutinine filamenteuse
A LIRE POUR VOUS INFORMER SUR LES VACCINATIONS !!











Pas évident pour les non initiés… Une « traduction » tout public serait bienvenue !